Cho ZH, Uwang SC, Wong EK, Son YD, Kang CK, Park TS, Bai SI, Kim YB, Lee YB, Sung KK, Lee BH, Shepp LA, Min KT. Neural substrates, experimental evidences and functional hypothesis of acupuncture mechanisms. Acta Neurol Scand 2006: 113: 370-7. University of Califórnia, Irvine, USA e Universidades da Coréia.
Resumido por Eliza Rumiko Iwahashi
Objetivos: Os autores estudaram o efeito analgésico da acupuntura (ACP) através da ressonância magnética funcional (fMRI) e propuseram uma hipótese para o papel do cérebro no tratamento por ACP.
Método: O modelo proposto, denominado “eixo hipotálamo-hipofisário-adrenal (HPA) senso amplo (BS) = BS-HPA”, foi baseado nos dados de neuroimagem observados, incorporando o modelo do eixo HPA induzido por estresse à interação neuroimune.
Resultados: Os resultados, aliados aos estudos prévios, sugerem o papel essencial do sistema nervoso central no processamento destes efeitos através da modulação do sistema nervoso autônomo (SNA), sistema neuroimune e regulação hormonal.
Conclusões: A compreensão dos mecanismos da ACP dentro de uma base neurocientífica é vital, como confirmam os estudos de fMRI. Os autores também propõem a teoria do eixo BS-HPA.
Hipótese de estimulação imunoneural e eixo HPA no mecanismo da ACP
Estudos de Tracey e cols. descrevem as interações entre o SNA e as funções imunes e destes com o cérebro. O dado inflamatório é transmitido através de nervos sensitivos ao hipotálamo, gerando uma resposta via SNA, onde as citocinas (fator de necrose tumoral (TNF), e outras, como a interleucina-1ß) se comunicam com o cérebro, e as terminações nervosas parassimpáticas liberam acetilcolina (ACh) que parece ter o papel de suprimir a liberação de citocinas (IL-1ß). Também o complexo dorsal vagal e o núcleo motor dorsal do vago respondem a concentrações de TNF circulante, ativando o eixo HPA e induzindo a liberação de glicocorticóide (entre outras substâncias), suprimindo a síntese adicional de citocina.
Os sinais de estímulo da ACP podem ser transmitidos em nível supraespinal pela indução de reflexos antiinflamatórios através de mecanismos humoral e neural. Podem estar envolvidos 3 modos diferentes de estimulação sensorial da ACP ou similar: 1) Acupuntura AV (ACP por nervo vago aferente): reflexo antiinflamatório via núcleo do trato solitário (NST) e eixo HPA. 2) Acupuntura EV (ACP por nervo vago eferente): via núcleo motor dorsal do vago. 3) Acupuntura AS (ACP por nervo somático aferente): via outros núcleos centrais diferentes do NST, ou via NST, ou ambos, além de fluxo simpático a partir do hipotálamo, possivelmente via eixo BS-HPA. Este seria o modo mais freqüente de estimulação por ACP.
Tais estímulos alcançam o núcleo paraventricular (PVN) do hipotálamo por meio de 4 vias principais: o sistema límbico e o córtex pré-frontal (LIM), a área circunventricular (CV), a estimulação sensorial e o hipotálamo (HYP); sendo a estimulação sensorial o foca deste trabalho sobre ACP.
As respostas principais a partir do PVN aos estímulos sensoriais da ACP ou similar podem ser transportadas através de 5 diferentes vias:
- Humoral, origina-se do eixo HPA para os vários órgãos e para o cérebro pela corrente sangüínea, sendo que uma libera glicocorticóides e citocinas antiinflamatórias, pela ativação de leucócitos, e outra libera 13-endorfinas, através do SNC;
- Via neurohumoral, que libera norepinefrina (NE) através do sistema nervoso autónomo hipotalâmico (HAS), suprimindo a inflamação através do receptor 13- adrenérgico ([3-AR) no macrófago;
- Via neural, provavelmente se origina do eixo HA S via medula espinal, libera também NE e 1L-10 através da via de ativação 13-AR,
- Via nervo vago parassimpático autonômico hipotalâmico (HAP), dirigida a macrófagos e células dendríticas e interage com receptor nícotínico ACh, suprimindo a síntese de TNF-a e IL-1[3.O efeito antiinflamatório desta via colinérgica através da estimulação do nervo vago é um mecanismo que poderia explicar um dos efeitos benéficos da ACP;
- Via neural, acoplamento direto do núcleo paraventricular e núcleo arqueado do hipotálamo à substância cinzenta periaquedutal (PAG), depois ao núcleo da rafe e ao corno dorsal da medula espinal. Esta via é a conhecida via descendente central inibitória da dor na medula espinal que modula a via ascendente da dor a partir da periferia.
Evidências experimentais e hipóteses de mecanismos da ACP
Resposta imune pela ACP
Foi avaliado o efeito antiinflamatório da eletro-ACP, medindo-se a resposta a 2 diferentes freqüências (2 Hz=grupo I; 100 Hz=grupo II) em ratos, 3 dias após a indução de pancreatite aguda por colecistocinina, aplicadas 1 vez ao dia por 20 min, por 7 dias sendo o animal sacrificado 12 h após a última estimulação. Foram medidos: peso do pâncreas, proteínas cardíacas de choque (HSPs), P-amilase, lipase, 1L-13 e TNF-a.
Resultados:
- A relação peso do pâncreas/ peso corporal (3,45 ± 0,51 no grupo I; 3,79 ± 0,23 no grupo II) estava significativamente diminuída comparada com o grupo controle (4,61 ± 0,31).
- As expressões de HSP60 e HSP72 nos grupos I e II estavam mais aumentadas do que no grupo controle, especialmente no grupo
- A 13-amilase e a lipase estavam significativamente diminuídas nos grupo sI e II, enquanto aumentaram significativamente no grupo controle, comparado ao grupo normal.
- A IL- 43 estava significativamente diminuída abaixo de 0,32 ± 0,16 e 0,98 ± 0,70 ng/ml respectivamente no grupo I e II comparado com o grupo controle (1,74 ± 0,37 ngfml), que mostrou aumento de mais de 10 vezes que no grupo normal (0,12 ± 0,13 ng/ml).
- A liberação de TNF-a diminuiu para 41,7 ±7,18 e44,5 ± 10,15 pg/ml, respectivamente no grupo I e II, e no grupo controle (50,50 ± 9,29 pg/ml) estava mais aumentado do que no grupo normal (39,60 ± 11,87 pg/ml).
Os resultados acima sustentam fortemente a hipótese dos autores de que a estimulação por ACP altera a resposta imune, como evidenciado por uma diminuição das citocinas pró-inflamatórias.
Dor sustentada aumenta a liberação de opióides endógenos
Os receptores s-opióides são distribuídos em áreas específicas como o córtex cingulado anterior (ACC), o hipocampo e a maior parte do tálamo, conforme os estudos em ratos e em cérebro humano.
Observação recente por meio do PET, com radiomarcador seletivo de receptor de, sugere que a dor sustentada (como o estímulo da acupuntura) produz um aumento na liberação de opióides endógenos no córtex cingulado ou no ACC e no tálamo.
Papel do ACC rostral na modulação da dor
Petrovic e cols. investigaram as regiões cerebrais comumente ativadas durante a administração de opióide (ramifentanil) e de placebo (SF), sendo demonstrado o ACC rostral (rACC) em ambas as condições.
O aumento do fluxo sangüíneo no rACC após a aplicação de estímulo doloroso juntamente com o placebo sugere que este leva à indução de opióides endógenos de modo similar à administração de opióide exógeno. Resultado similar foi observado em alguns estudos de dor utilizando fMRI, sugerindo a participação de rACC.
Estímulos de ACP e similar diminuem a dor
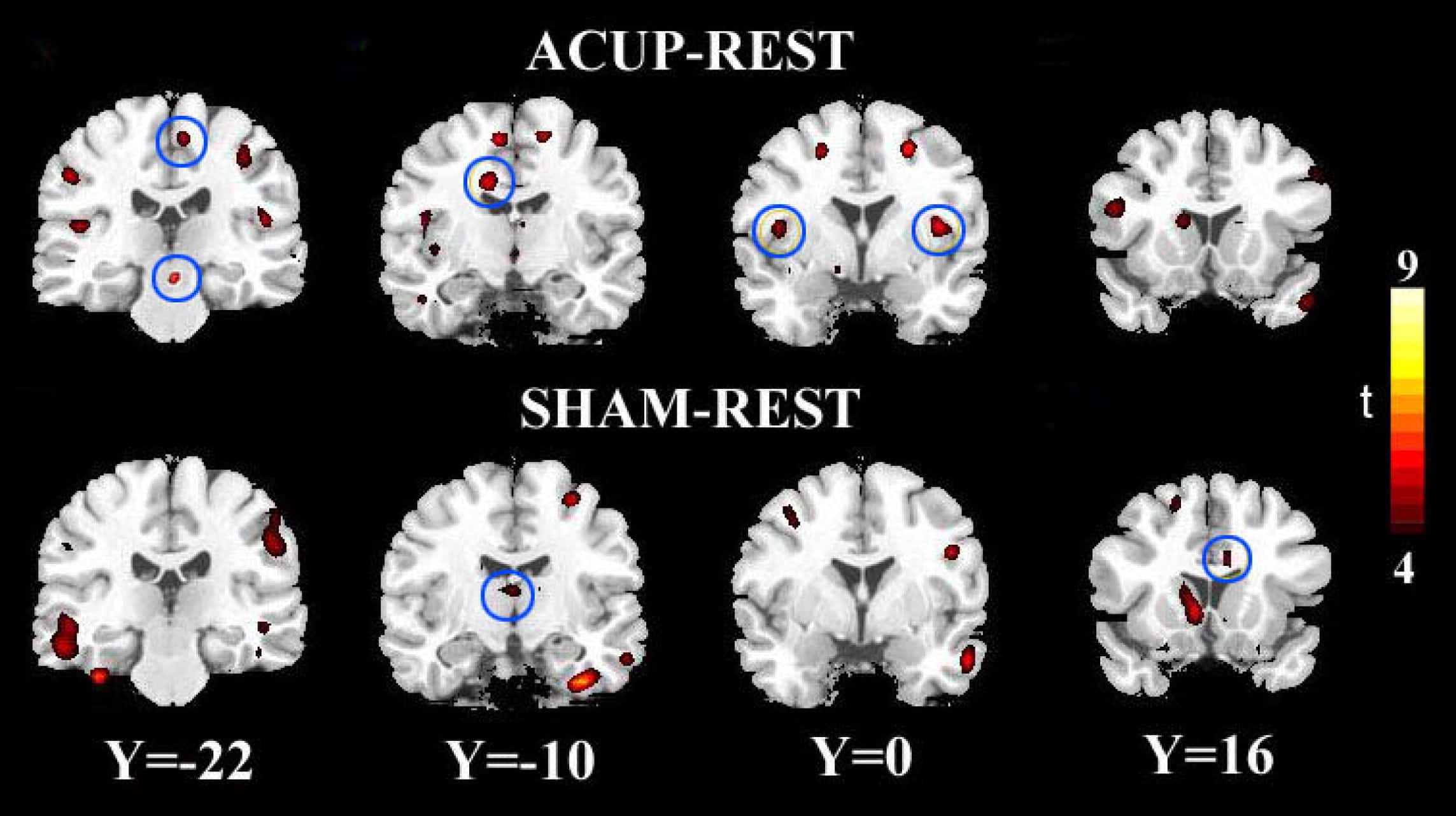
Observação por meio da fMRI mostrou que o estímulo doloroso ativou a maioria dos centros processadores da dor conhecidos no ACC (dorsal, caudal e rostral), juntamente com as áreas motoras e o tálamo. Estas áreas diminuem substancialmente sua atividade após a administração de acupuntura nos pontos tradicionais, mostrando que são dessensibilizadas pelo estímulo da acupuntura.
A aplicação de ACP nos pontos sham mostrou similaridade nos resultados de fMRI (ponto de acupuntura sham escolhido longe do ponto no meridiano e aplicada uma estimulação de intensidade similar à outra técnica).
Este estudo sugere que a acupuntura é efetiva no alívio da dor independente da escolha do ponto, embora com diferenças na sua eficácia. Os autores sustentam a hipótese de que a analgesia por acupuntura é simplesmente o efeito da resposta do eixo HPA induzido por estresse do estímulo da acupuntura; além disso, que a diminuição da ativação das áreas relacionadas à dor pode ser em decorrência do “estresse da dor sustentada” em qualquer parte do corpo, mais que a estimulação de um ponto específico de acupuntura, ativando o eixo HPA, portanto, reduzindo ou inibindo os sinais ascendentes da dor através do circuito endógeno opiáceo central.
Número crescente de relatos de pesquisas recentes sustenta a visão de que os mecanismos de ACP podem ser explicados em bases moleculares e neurofisiológicas, especificamente através do eixo BS-HPA, que não só compartilha a conhecida teoria inibitória central descendente da dor envolvendo os opióides endógenos, mas também sugere que há um possível mecanismo antiinflamatório em conjunção com as vias neuroimunes e o mecanismo colinérgico antiinflamatório.
Os mecanismos do tratamento por ACP estão sendo verificados com a ajuda de métodos de imagem molecular recentemente disponíveis como o PET e a fMRI.
Estudos futuros sobre a ACP são necessários para avaliar vários parâmetros que podem afetar a estimulação por ACP, tanto nos aspectos técnicos (intensidade de estímulo, freqüência, duração, taxa de repetição, etc.) quanto nas diferenças fisiológicas do paciente (constituição física, condições patológicas, ritmo circadiano).

AL. JAÚ 687 – JARDIM PAULISTA – SÃO PAULO – SP
Clínica de Dor, Fisiatria e Acupuntura Médica
Clínica médica especializada localizada na região dos Jardins, próximo à Av. Paulista, em São Paulo — SP.
Centro de Dor, com médicos especialistas pelo Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo.
Tratamento por Ondas de Choque, Infiltrações, Bloqueios anestésicos e Acupuntura Médica
Dor tem Tratamento – Centro de Dor e Acupuntura Médica em São Paulo – SP

Médicos Especialistas em Dor e Acupuntura do HC-FMUSP
Os especialistas em medicina da dor são médicos especialmente treinados e qualificados para oferecer avaliação integrada e especializada e gerenciamento da dor usando seu conhecimento único e conjunto de habilidades no contexto de uma equipe multidisciplinar.
O tratamento da dor visa reduzir a dor, abordando o impacto emocional da dor, ajudando os pacientes a se moverem melhor e aumentando o bem-estar por meio de uma variedade de tratamentos, incluindo medicamentos, fisioterapia, acupuntura, ondas de choque e procedimentos minimamente intervencionistas.
Se você está vivendo com uma dor persistente há mais de 3 meses, provavelmente está sentindo dor crônica.
Nossos médicos especialistas em controle da dor em São Paulo trabalham em estreita colaboração com outros especialistas como parte de uma equipe multidisciplinar para fornecer uma abordagem holística e um resultado ideal para a dor crônica, seja qual for a causa.
As técnicas usadas no controle da dor dependerão da natureza e gravidade da dor, mas nossos especialistas em dor têm experiência para ajudar com a dor.

-
01.Tratamento conservador de dor
Acupuntura Médica, Ondas de Choque, Fisioterapia, Infiltrações, Bloqueios Anestésicos, Toxina Botulínica. -
02.Excelência em um só lugar
A avaliação e tratamento da dor é a especialidade de nossos Médicos especialistas em Dor. -
03.Tratamento individualizado
Plano de tratamento com medicamentos, terapias minimamente invasivas e fisioterapia.
Atendemos todos os Planos de Saúde pelo Reembolso.
O reembolso ou livre escolha é uma opção de atendimento a usuários de planos de saúde que não está vinculada à rede de prestadores contratados ou cujo procedimento específico não está contratado.
Não atendemos diretamente por convênio. Nosso foco é um atendimento especializado no paciente. Assim, separamos pelo menos 60-90 minutos para consulta, exame e avaliação do paciente.
O processo na maioria das vezes é digital (pelo Smartphone, tablet ou computador) é simples. O valor reembolsado corresponde a uma tabela de valores da própria operadora e pode cobrir todo o procedimento ou parte dele. Lembrando que a parte não reembolsada pode ser abatida no imposto de renda pessoa física (IRPF).
Clínica Dr. Hong Jin Pai – Centro de Dor, Acupuntura Médica, Fisiatria e Reabilitação.
Al. Jaú 687 – São Paulo – SP
Atendimento de segunda a sábado.
